质子交换膜燃料电池(Proton Exchange Membranes Fuel Cells,PEMFCs)作为燃料电池的一种,从19世纪60年代研究之初至今,已取得极大的进展。它具有能量转化率高(40 - 60 %)、环境友好、工作寿命长、操作温度低等优点,人们也越来越关注其发展和应用,特别是在汽车动力、移动电源及小型电站等方面有着非常广泛的应用前景[1]。
目前,随着我国环境的污染和国家向高新技术转型的大战略下,新能源的需求越来越大,新能源的开发也受到了人们的特别重视。以氢气为燃料、氧气(或空气)为氧化剂的 PEMFCs 已然成为燃料电池研究的主流。由于PEMFCs在放电过程中只排放水,而且有能够快速启动、比功率和比能量高的优点,被公认为是解决新能源汽车电池问题的最好方法。
那么PEMFCs的工作原理是什么样的呢?如图1.1所示,PEMFC单电池的主要组成是:气体流场/双极板,质子交换膜,垫圈,电极/催化层&扩散层,其中它的核心部件是电极与质子交换膜构成的膜电极(Membrane Electrode Assembly,MEA),是发生电化学反应的主要场所。其工作原理是:电池阳极侧H2通过流道到扩散层,在进入催化层之后发生氧化还原反应(催化层是一个由质子传导介质、催化剂和电子传导介质构成的三相界面)并产生质子(H+)释放出电子(e-)(式1.1),产生的电子通过外电路到达阴极并得到电流,质子通过电池内部的质子交换膜到达阴极,阴极催化层此时通入的氧气在三相界面上与质子电子发生反应生成H2O(式1.2),所以只要不中断原料,电池外电路就产生了持续电流[2]。根据阴阳极电化学反应的标准电极电势可知,25℃下PEMFC的理论开路电压为1.229 V。
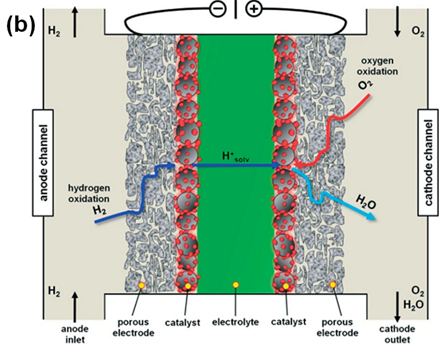
图1.1 PEMFC的单池组成以及工作原理示意图[3]
阳极:H2 → 2H+ + 2e- Ea0=0.00 V vs. SHE (1.1)
阴极:1/2O2 + 2H+ + 2e- → H2O Ec0=1.229 V vs. SHE (1.2)
总反应:H2 + 1/2O2 → H2O Ecell0 = 1.229 V (1.3)
1.2 ORR还原机理
氧气还原反应(Oxygen Reduction Reaction, ORR)是燃料电池中的关键步骤[4]。如果能理解并深入研究ORR的反应历程,将对高活性的催化剂研究起到很大的助推作用。如表1. 1 所示,ORR是一个具有多步骤的反应,而且在不同催化剂条件下,反应历程或许也不同,可分为:四电子途径直接生成H2O(酸性介质)或OH-(碱性介质),或者以生成H2O2(酸性介质)或HO2-(碱性介质)为中间产物,进行两步电子途径。来!自~优尔论-文|网www.youerw.com
表1. 1 酸性和碱性介质中的ORR反应机理
酸性介质 碱性介质
4e-电子途径 O2+4H++4e-→2H2O
O2 +2H2O+4e-→4OH-
2e-电子途径 O2+2H++2e-→H2O2
O2+H2O+2e- →OH-+HO-2
H2O2+2H++2e-→2H2O
HO-2+H2O+2e- →3OH
普遍认为,氧气还原反应是否发生决定于氧氧键的断裂。根据分子轨道理论,催化剂表面会吸附氧分子,然后电子从π成键轨道转移到催化剂d空轨道,同时,d轨道的电子会被转移到氧气分子的π*反键轨道,这也就意味着削弱了O-O键,然后价键断裂并发生氧化还原反应。催化剂吸附氧气分子在其表面,Yeager[5]认为应该有三种可能 离子液体对氧还原催化剂(PtNi合金)性能影响的研究(2):http://www.youerw.com/huaxue/lunwen_78909.html

