(2) 电池的耐久性存在问题。随着电池使用时间的增加,电池的性能衰减也在增加,使得电池使用寿命降低。特别是在汽车领域的应用,电池的启动停止频率较高,对电池的使用要求较高,更容易加剧电池的衰减。
(3) 燃料供给困难。特别是使用氢气作为电池的燃料,氢气的存储运输比较困难,相应的氢燃料供给站还需要建设,极大阻碍了电池的使用。目前的储氢方法可以实现的储氢容量不高,从很大程度上制约了燃料电池高能量密度的实现。如果使用煤气或者其他非氢气气体燃料,还需要对燃料进行重整,加大了成本的投入。[2]
1.3 直接硼氢化钠-双氧水燃料电池(DBHFC)
1.3.1 DBHFC的特点
使用氢气的质子交换膜燃料电池近些年来获得了广泛的关注,尤其是在电动汽车等大型牵引动力源方面的研究取得了很多进展。但由于氢气储存困难,便携性差等不足限制了其在小型可移动电源方面的应用,人们一直试图寻找替代氢气的液体燃料,其中以甲醇作为燃料的直接甲醇燃料电池(DMFC)被认为在此领域大有作为。然而甲醇氧化速度慢,甲醇渗透等问题一直没有彻底解决,使得DMFC商业化过程中遇到了很多阻力。[3]
硼氢化物同样作为一种液体燃料,具有便于储存、运输等特点,更为重要的是它的活性要远高于醇类燃料,而且如果采用双氧水作为氧化剂,整个反应将不依赖空气。[4-5]直接硼氢化物-过氧化氢燃料电池是直接硼氢化物燃料电池的一个重要分支。以过氧化氢为氧化剂时,过氧化氢在阴极电还原只转移两个电子,比氧气还原容易得多,因此可以获得更大的功率密度。而且以过氧化氢为氧化剂可构成全液态的燃料电池,这种电池能产生较高的理论电压,可广泛应用于水下和宇宙等无氧环境中。[6]
与O2相比,H2O2作氧化剂有以下优点:(1) H2O2是强氧化剂,通过使用合适的催化剂,可转化为羟基基团(OH-),活性仅次于氟。(2) H2O2是液态,比气态氧化剂更容易处理、储存及添加到燃料电池中,使系统结构更加紧凑简便。(3) H2O2的电还原是2电子转移过程,而O2是4电子转移过程,因此H2O2的活化能更低。(4)H2O2在燃料电池阴极的电还原反应发生在固/液两相界面,而O2电还原需要固/液/气三相界面(即气体扩散电极),两相界面更加稳定。
1.3.2 DBHFC的工作原理
图1.1为直接硼氢化物-过氧化氢燃料电池的工作原理示意图 。
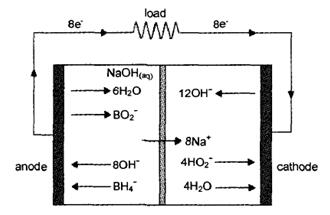
图1.1 DBHFC的工作原理示意图
在电化学反应过程中,BH4-经过8电子转移氧化成BO2-,平衡电位为-1.24V(vs.SHE),硼氢化钠作为反应燃料的反应方程式如下:
阳极:BH4-+8OH- BO2-+6H2O+8e- E=-1.24V vs. SHE (1.1)
当电池的阴极电解液为碱性时,阴极电极反应为:
4 H2O2+8 e- 8 OH- E=0.87V vs. SHE (1.2)
总反应方程: BH4-+4 H2O2 BO2-+6 H2O (1.3)
其理论开路电压和比能量分别为2.11 V和11959Wh/kg。
当电池的阴极电解液为酸性时,阴极电极反应为:
4 H2O2+8H++8e- 8 H2O E=1.77 V vs. SHE (1.4) 不同组成Pt-Co合金催化剂的电催化还原H2O2性能研究(3):http://www.youerw.com/huaxue/lunwen_10194.html

