锂离子电池的电化学性能主要取决于所用正负极材料和电解质材料的结构和性能,尤其是正负极材料的选择和质量直接决定着锂离子电池的特性和价格。廉价、高性能的正负极材料的研发及选用合适的电解质一直是锂离子电池研究的重点。目前锂离子电池及其材料技术已成为全世界各国关注的一个科技和产业焦点,也是我国能源领域重点扶持的高新技术产业。[2]
1.2 锂离子电池简介
1.2.1 锂离子电池发展历史
锂是最轻的金属元素,原子量为6.94,也是标准电极电位最负(-3.045 V)的金属,所以锂是一种具有高比能量的材料,其组成的电池有高质量比容量和高输出电压。锂二次电池的研究最早开始于20世纪60~70年代,主要以金属锂及其合金作为负极[3]。这种电池在充电过程中由于锂电极表面的凹凸不平导致电势分布不均,造成锂的不均匀沉积而产生锂枝晶。随着充放电的继续,枝晶不断生长,当枝晶长到一定程度,就会发生折断产生死锂;另一方面会穿透隔膜,造成短路,引起电池着火甚至爆炸。这一系列因素导致金属锂二次电池循环性能差和安全性等问题,因此Li-TiS2体系未能实现商品化。为了克服锂电池的这种不足,提高电池的安全可靠性,人们采取了多种方法。例如,针对负极和电解液主要分为两种:一种方法是将负极金属锂换成锂合金或化合物,使锂以离子状态存在于电池中,从而避免了锂枝晶的产生。尽管锂合金负极的使用解决了金属锂负极的安全隐患,但是,锂合金在循环过程中会发生非常大的体积变化,导致电极材料粉化,容量迅速衰减;另一种方法是将有机电解液改换为固态聚合物电解液,也就是通常我们所说的锂聚合物电池,但是这种电池只能在高于 80 ℃ 的条件下有效地工作[4],限制了其应用范围。
1980年,Armand率先提出了RCB概念,锂蓄电池负极不再采用金属锂,而是正负极均采用能让锂离子自由脱嵌的活性物质。从此以后,锂电池得到了迅猛的发展。1990年日本的索尼(Sony)公司率先研制成功锂离子电池,它是把锂离子嵌入碳中形成负极,取代传统锂原电池的金属锂或锂合金作负极。1992年,锂离子蓄电池实现商品化,1999年,聚合物锂离子电池实现商品化[5]。
1.2.2 锂离子电池工作原理
锂离子电池的基本结构主要由正极材料、电解质、隔膜和负极材料等几部分组成。
商业化的锂离子电池正极材料一般是含锂的过渡金属氧化物,如钴酸锂、锰酸锂等,作为锂源提供锂离子。负极较多使用的是石墨,其层间的孔隙提供了插锂的空位。电解液作为锂离子的导体,主要采用锂盐和混合有机溶剂所组成的溶液。隔膜一般是多孔的聚烯烃,用于隔离正极和负极,防止电池短路。
锂离子电池工作原理如图1-2所示。
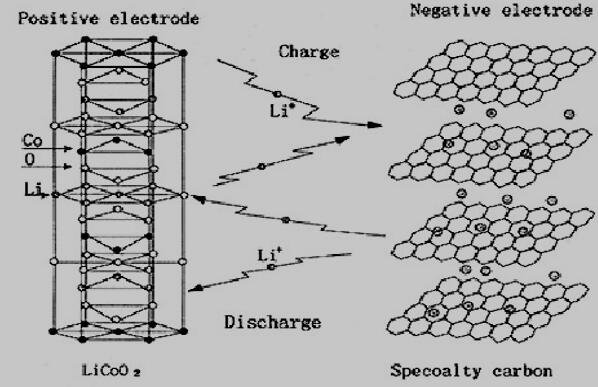
图1-2 锂离子电池工作原理
正极反应:放电时锂离子嵌入,充电时锂离子脱嵌。
负极反应:放电时锂离子脱插,充电时锂离子插入。
电池总反应
以炭材料为负极,以含锂的化合物作正极的锂电池,在充放电过程中,没有金属锂存在,只有锂离子,这就是锂离子电池。当对电池进行充电时,电池的正极上有锂离子生成,生成的锂离子经过电解液运动到负极。而作为负极的碳呈层状结构,它有很多微孔,达到负极的锂离子就嵌入到碳层的微孔中,嵌入的锂离子越多,充电容量越高。同样,当对电池进行放电时(即我们使用电池的过程),嵌在负极碳层中的锂离子脱出,又运动回正极。回正极的锂离子越多,放电容量越高。我们通常所说的电池容量指的就是放电容量。在Li-ion的充放电过程中,锂离子处于从正极→负极→正极的运动状态。Li-ion Batteries就像一把摇椅,摇椅的两端为电池的两极,而锂离子就像运动员一样在摇椅来回奔跑。所以Li-ion Batteries又叫摇椅式电池。 石墨纳米笼用于锂离子电池负极材料的研究(2):http://www.youerw.com/huaxue/lunwen_18177.html

