CA-4和它的前药Combretastatin A-4 Phosphate(CA-4P)具有相同的作用机制,但后者对肿瘤的选择性较高。因为磷酸酯酶在增殖的血管内皮细胞中的浓度比在静止的细胞中要高得多。CA-4P显著改变新生血管内皮细胞的构象,改变毛细血管血流量,暴露血管基底膜.引起广泛的出血和凝血,对处于分裂状态的内皮细胞具有强烈的细胞毒和抗增生效应,而对处于静止状态的细胞无明显作用。
对于CA-4作用机制的进一步研究,能够解释CA-4微管抑制活性好,而细胞毒活性低的原因,从而为将来CA-4的结构修饰提供更有利的指导。对已知有药效的分子进行结构修饰是获得药效更好、毒性更低的药物的有效办法,也是新药开发的重要途径。为了提高CA-4的活性和减少毒副作用,研究者们就以它为母体结构不断对它进行修饰。相信随着对CA-4结构修饰和作用机理的研究的深入,会有更多的微管蛋白抑制剂进入临床研究,为肿瘤的治疗提供一类新的更加有效的治疗手段。
1.2 研究现状和进展
CA-4是一个有效地微管蛋白抑制剂,人们研究CA-4的结构发现,其与秋水仙碱比较相似,具有1个顺式乙烯桥连接的两个苯环的基本结构。但其水溶性较差而导致难以静脉给药和易变构为反式而致活性消失的特点限制了其临床价值,因此,科学家们以CA-4为母体化合物进行了大量的研究工作。同时构效关系研究表明,保持顺式构型对CA-4的生物学活性有着重要意义。对CA-4的结构修饰研究主要可以分为以下几种: 1,A环上取代基修饰;2,B环上的结构修饰;3,连接A环和B环的桥状结构修饰;4,增加水溶性方面。
A环上的三甲氧基对保持抗肿瘤活性有着重要作用。连接AB环的桥式结构可以是双键杂环( 如吡唑噻唑咪唑唑呋喃噻吩三唑四唑及吲哚等) 及非杂环结构( 醚酮磺胺磺酸酯胺胺衍生物及环戊烷等),连接两环的原子数可以2或3,但以2个为最佳,且顺式是活性必需构型。B环上的甲氧基为文持活性的重要基团,而3位的羟基是修饰的重要部位。(如图1-2)
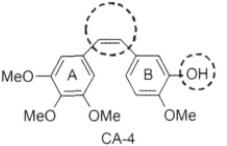
图1-2 Combretastatin A-4
1.2.1 增加水溶性
CA-4水溶性较差,难以经血管给药。CA4P作为CA-4的前体药物,极大地改善了CA-4的水溶性和药代动力学性质,利用磷酸酯酶在增殖的血管内皮细胞中的浓度高于正常细胞的特点,使CA4P在肿瘤血管中被选择性激活,靶向释放出CA-4并发挥抗血管抗肿瘤作用。I 期临床研究表明,CA4P表现出很好的活性,并有很好的耐受性且无血液毒性,现已进入III 期临床试验阶段。另外一种增加水溶性的方法是在羟基接上水溶性较强的基团,如Megan[4]等设计和合成了一系列的化合物,水溶性明显增大。
1.2.2 A环的结构修饰
一直以来,三甲氧基苯基即A环部分一直被认为是保持抑制微管蛋白活性和细胞毒性的重要基团。Pettit[5]等用卤素替代A环3位甲氧基发现细胞毒性作用和微管蛋白结合活性都有下降。John[6]等将A环的3个甲氧基全部用氟替换,其生物活性大幅下降,只有微弱的抗肿瘤活性。因此认为,保持A环的3个甲氧基对保持CA-4的生物活性有着重要的作用。但是,最近的一些研究显示,以其他的一些取代基替代三甲氧基而衍生出来的化合物也显示出了良好的微管蛋白抑制活性。
Chang[7]等合成了一系列在A环的2位上引入一个硝基氨基的CA-4衍生物,其中2-氨基取代化合物的抗微管活性与CA-4相近甚至好于CA-4,对多种肿瘤细胞的IC50值在11~44nmol L-1之间,而在2位上的硝基替代活性下降明显。Simoni[8]等用苯并噻吩等杂环替代A环合成了一系列衍生物,活性普遍较好,其中又以苯并噻吩类化合物7f 活性最好,不仅能有效抑制微管蛋白,对BMEC和HT-29细胞的IC50值也分别达到20和21nmol L-1。 新型五元杂环类Combretastatin A-4 类似物的3D-QSAR研究及设计(3):http://www.youerw.com/huaxue/lunwen_17730.html

