在实验室研究和工业制药中,微量成分和污染物的分析需要高灵敏度的机制来进行分离和检测。被分析成分的含量常常只占0.001%,甚至更低。除此之外,随着效力更强的药物试剂被发现或合成,对测定生物样本中更低浓度或更小剂量成分的需求也不断增加。
毛细管电泳 [ - ](capillary electrophoresis,CE)作为一种新的检测技术,能够对微量成分提供有效、快速的分析和分离。除此之外,它还具有自动化程度高、灵敏度高、样品用量少、花费小等优势。因此CE在医药、生物分析等方面展现出了强大的前景。
1.1.1 手性及手性药物
手性(chirality)其实是一种广泛存在的现象。化合物中一个C原子上连有4个不同的基团,我们就称之其具有手性。手性分子与其镜像不重合,就像人的左右手一般,如图1.1所示。手性药物是通过具有立体选择性的分子识别来发挥药理作用的,这使手性药物的两个对映体在药物疗效、药物代谢和毒副作用等方面具有明显的不同。在医药领域,可以很容易找到两个对映体具有不同药理学活性的例子。如左旋肾上腺素比其对映体有效10倍,左旋心得安,一种用于治疗高血压的β-受体阻滞剂,比其对映体有效100倍。
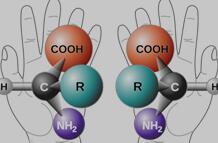
图1.1 手性分子示意图
在手性药物尚未被人们重视的上世纪优尔十年代,欧洲大陆发生了令人震惊的“反应停事件”。很多孕妇服用了消旋体药物沙利度胺,产生了骇人的副作用——生出了大量“海豹畸形婴儿”,这些婴儿有的四肢畸形,有的先天聋哑,还有的内脏畸形,很是可怖。后来经过研究发现,R-(+)-沙利度胺具有镇静作用,但S-(-)-沙利度胺对胚胎有很强的致畸作用。这一悲剧引起了人们对手性药物的关注。当今的药物在研发成功后,为了避免其中含有对人体有强烈副作用的药物单一对映体,必须要经过生物活性和毒性试验。目前世界上常用的化学药物中手性药物超过了一半,而且还在持续增长中。所以,制备单一构型的纯手性药物具有非常重大的意义及市场。
1.1.2 手性药物制备技术
目前手性药物的制备技术主要分为三大类:天然物提取法、不对称合成法和外消旋体拆分法[ ]。
天然物提取法:某些生物体中含有具备生理活性的天然产物,可用适当的方法提取而得到手性化合物 [ ]。
不对称合成法:以纯手性化合物为原料合成目标手性分子,或在手性底物的作用下将潜手性化合物转变成手性化合物[ , ]。
外消旋体拆分法:主要分为酶法、膜拆分法、化学拆分法、模拟流动床法、色谱拆分法五大类[ ]。相对其它方法而言,外消旋体拆分法所需的成本较为低廉,目前在实验室研究和临床上的应用也最为广泛。当今随着现代分析仪器研制和开发的迅速发展,应用色谱仪器进行手性药物的分析及分离最为广泛,效果也最理想。
混合物中的各组分在固定相和流动相两相之间的分配系数不同是色谱法分离的基本原理[13]。各个组分由于自身性质的差异,在两相中的扩散不均匀。各组分在两相中经过反复的吸附和解吸附,从固定相中洗脱出来的顺序不同,从而能实现各个组分的相互分离。色谱法主要分为:柱色谱法[ ](CC)、薄层色谱法[ ]、气相色谱法[ ]、高效液相色谱法[ ]和毛细管电泳法等。CE具有快速、高效、所需样品量少、操作简单等优势,应用十分广泛,已成为分析化学中生命科学领域发展和应用最快的技术之一。和目前常用的HPLC相比,毛细管电泳法也有着显著的优点。如HPLC的样品需要进行预处理,步骤较为繁琐,而毛细管电泳一般不需要对药品进行预处理,大大简化了操作;毛细管电泳的峰容量为11~15/min,而HPLC的峰容量则小于5/min。二者之间的比较如表1.1所示。 γ-环糊精在毛细管电泳中对N-Fmoc氨基酸的手性分离(2):http://www.youerw.com/yixue/lunwen_23794.html

