1.1 锂离子电池简介
1.1.1 发展现状
锂是自然界金属中标准电位最低(-3.045V),质量最轻(6.941g/mol),能量密度最高(体积比容量为2.06Ahcm-3,质量比容量为3860mA hg-1)的金属。这些优良的自然属性决定了它是电池材料的必然选择[1]。锂作为电池材料的研究经历了锂一次电池、锂二次电池、新一代实用化的新型锂离子二次电池—液态锂离子电池[2]的历程。在这种电池中,正极和负极材料均采用锂离子的嵌入和脱出材料。充电时,锂离子从正极脱出嵌入负极,放电时,锂离子又从负极脱出嵌入正极,人们把这种电化学体系形象地描述为“摇椅式电池”[3]。它既保持了锂电池高电压、高容量的主要优点,又具有循环寿命长、安全性能好的显著特点,在便携式电子设备、电动汽车、电动工具、空间技术、国防工业等多方面展示了广阔的应用前景和潜在的巨大经济效益[4]。自此,锂离子电池研究进入一个崭新的时代。近几年又发展了聚合物锂离子电池,它用铝塑膜取代金属壳作包装材料,使重量更轻,这使锂离子电池的重量比能量和体积比能量更高,安全性能更进一步提高。
1.1.2锂离子电池的工作原理
锂离子电池是指含有可嵌入和脱出Li+的正负极材料的一种可充放电高能量电池[5]。其正极材料一般采用插锂化合物,如 LiCoO2、LiMn2O4、LiNi1/3Co1/3Mn1/3O2LiFePO4等[6-8]。电解质是含锂盐的有机溶剂,其中锂盐主要是 LiPF6、LiAsF6、LiClO4等[7],有机溶剂主要是碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、碳酸二甲酯(DMC)、氯碳酸酯(ClMC)等[8]。在充放电过程中,Li+在两电极间往返脱嵌,被形象地称为“摇椅电池”(rocking chair batteries),如图1.1 所示。
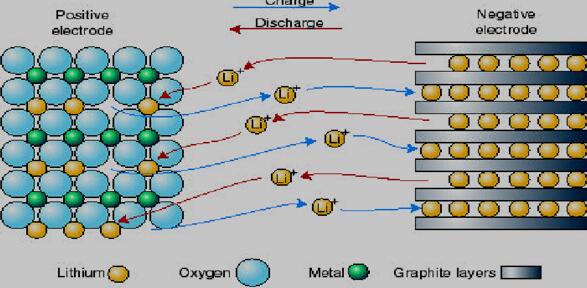
图1.1 锂离子电池的工作原理图
锂离子电池的化学表达式为:
(-)Cn| LiPF6-EC+DMC | LiMxOy(﹢)
电池反应则为:LiMxOy+ nC → Li1-xMxOy+ LixCn
锂离子电池实际上是一种锂离子浓差电池[9]。充电时,Li+从正极脱出,经过电解质嵌入到负极,负极处于富锂状态,正极处于贫锂状态,同时电子的补偿电荷从外电路供给到碳负极,确保电荷的平衡。放电时则相反,Li+从负极脱出,经过电解质嵌入到正极,正极处于富锂状态,负极处于贫锂状态。在正常充放电情况下,锂离子在层状结构的碳材料和层状结构氧化物的层间嵌入和脱出,一般只引起材料的层面间距变化,不破坏材料晶体结构,在充放电过程中,负极材料的化学结构基本不变。因此,从充放电反应的可逆性看,锂离子电池反应是一种理想的可逆反应[10]。
以正极是 LiFePO4材料的锂离子电池为例,从电池工作原理示意图可见,充电时,锂离子从 LiFePO4晶胞中脱出,其中 Fe2+氧化为 Fe3+,放电时,锂离子则嵌入FePO4晶胞中,其中 Fe3+还原为 Fe2+。锂在元素周期表中是电极电势最负的单质,所以电池的工作电压可以达到 3.35V。
1.1.3 LiFePO4的结构
LiFePO4晶体的结构示意图如图1.2所示[11]:从图中可以看出LiFePO4的晶体结构是属于正交晶系中的一种有序的橄榄石结构,即每4个LiFePO4微单元组成一个晶胞。在LiFePO4单元中O原子呈现出优尔方紧密堆积晶体的结构,Fe原子和Li原子分别占据了氧原子堆积的如图1.2所示的4c和4a位置,而P原子则存在于4c位。
此外,从图中可以看出在O原子单元的b-c所构成的面上,Fe和O所形成的FeO6八面体结构存在共点连接,即每一个FeO6单元分别和两个LiO6单元以及一个以四面体结构存在的PO4相连接,而对于PO4,则是与FeO6单元存在共棱的关系。而Li+处于整个结构的4a位置,这样便形成了与整个棱连续的直线链,且是平行于晶胞结构的C轴。正是因为这种复杂结构的存在,Li+在整个晶胞中具有了在二文平面的可移动性。因此使得Li+在电池充电或者放电的过程中存在脱出和嵌入的行为[12]。 反应物浓度对材料的影响+文献综述(2):http://www.youerw.com/cailiao/lunwen_28299.html

