表3-1 微波下反应条件的优化 10
1 前言
噻唑及其衍生物作为一类重要的具有生物活性的杂环化合物广泛存在于天然和非天然的产物中。噻唑类化合物显示出许多药理学性质[1],如抗糖尿病药、抗生素和抗真菌性[2-6]。此外,噻唑类化合物还可作为抗糖药物来提高靶组织的胰岛素敏感性,并且充当有效、具选择性的过氧化物酶体增殖活化受体γ(PPARγ)[7]。由于噻唑衍生物的生物意义,噻唑的合成已经引起了相当大的关注。例如,Obydennov和同事报道的通过丁炔二酸二甲酯与硫代乙酰胺反应合成一些噻唑、噻吩类化合物,但涉及的反应范围相当狭窄[8]。
图1-1 Obydennov课题组的合成过程
屠课题组用氰基乙酰胺与异硫氰酸酯反应,接着加入预处理过的环酮生成了一些1,3-噻嗪衍生物,但反应需要两步才能完成[9]。
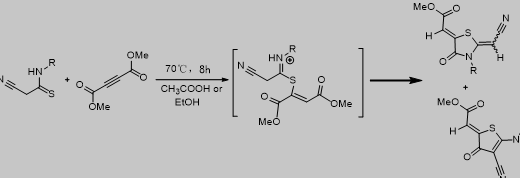
图1-2 1,3-噻嗪衍生物的合成过程
虽然已经有一些合成噻唑的方法以及用类似原料进行的反应,但这些反应都存在一些局限性,使得我们期望通过探索得到一种简单又操作性强的方法来合成新型多样的官能化噻唑类化合物。
“一锅”两步串联反应过程
为继续拓展上述反应[10],在本文中,我们报道了以氰乙酰胺1,异硫氰酸酯2和丁炔二酸二甲酯3a-b为起始原料来,通过“一锅”两步串联反应,合成了噻唑衍生物。该反应先通过氰基乙酰胺与异硫氰酸酯反应,原位得到2-氰基-3-巯基丙烯酰胺A,不分离继续与丁炔二酸二甲酯发生[3+2]环化,从而得到了多官能化噻唑衍生物4。用丙炔酸酯3c-d代替丁炔二酸二甲酯3a-b进行拓展反应,令人意想不到的是,该反应提供了syn-3-硫代丙烯酸酯6。(图1-4)。文献综述
图1-4 噻唑4和syn-3-硫代丙烯酸酯6的合成
2 实验部分
2.1实验仪器
瑞典Biotage公司微波合成仪、傅立叶红外光谱仪、Bruker DPX400MHz光谱仪、microTOF-QⅡ高分辨质谱仪 (BRUKER)、西门子CCD单晶衍射仪、西门子P4单晶衍射仪。
2.2实验过程(合成方法)
化合物4a的合成步骤
在10 ml的微波耐压管中加入苯基异硫氰酸酯(1.0 mmol)和氰基乙酰胺(1.0 equiv),在氢氧化钠(0.2 equiv)的DMF溶液中,在室温下搅拌30分钟,然后加入乙酸(2.0 ml)和丁炔二酸二甲酯(1.2 equiv.)。随后,将该混合体系在80 ℃下微波辐射20分钟。自动搅拌模式帮助混合反应物且能均匀加热。微波辐射后,通过TLC确定反应完毕后,将反应物冷却至室温,并加入冷水稀释反应混合物,过滤得到粗产物。将粗产物溶于95%EtOH重结晶,得到纯净的淡黄色固体。
(Z)-Methyl 2-(2-(2-amino-1-cyano-2-oxoethylidene)-4-oxo-3-phenylthiazolidin-5-ylidene)acetate (4a)
yellow solid; Mp: >300 oC; IR (KBr): 3469, 3355, 3319, 3248, 3168, 2210, 1731, 1699, 1667, 1591, 1536, 1499, 1448, 1372, 1325, 1244, 1203, 1015, 868 cm-1; 1H NMR (400 MHz, DMSO-d6) (δ, ppm): 7.785 (s, 1H), 7.581-7.542 (m, 5H), 7.354 (s, 1H), 6.790 (s, 1H), 3.814 (s, 3H); 13C NMR (100 MHz, DMSO-d6) (δ, ppm): 165.88, 164.71, 164.66, 161.63, 141.44, 134.55, 130.87, 129.54, 129.33, 116.89, 112.88, 81.54, 52.56. HRMS (ESI): m/z calcd for C15H11N3NaO4S, 352.0368 [M+Na] +; found: 352.0344.来!自~优尔论-文|网www.youerw.com
(Z)-Methyl 2-(2-(2-amino-1-cyano-2-oxoethylidene)-3-(4-fluorophenyl)-4-oxothiazolidin-5-ylidene) acetate (4b)
yellow solid; Mp: 288-289 oC; IR (KBr): 3509, 3436, 3407, 3337, 3293, 3242, 3196, 2202, 1737, 1721, 1656, 1602, 1531, 1508, 1434, 1374, 1239, 1262, 1055, 1026, 859, 703 cm-1; 1H NMR (400 MHz, DMSO-d6) (δ, ppm): 7.779 (s, 1H), 7.639-7.612(m, 2H), 7.432 (s, 1H), 3.775 (d, J = 8.4 Hz, 2H), 6.823 (s, 1H), 3.346 (s, 3H); 13C NMR (100 MHz, DMSO-d6) (δ, ppm): 165.78, 164.77, 164.56, 162.10, 141.44, 132.20, 131.91, 130.80, 117.10, 116.52, 116.22, 112.94, 81.33, 52.66. HRMS (ESI): m/z calcd for C15H10FN3NaO4S, 370.0274 [M+Na] +; found: 370.0270.