利奈唑胺的合成,在其原本的合成的工艺路线中一直采用BuLi、-78℃、氮气保护等实验条件下,这样的敏感试剂和苛刻的实验条件非常不利于流水线的工业化生产。De Sheng YU, Liang Huang, Hui Liang等人对利奈唑胺的合成工艺进行了改进,他们首先合成5-氯亚甲基噁唑烷酮,然后通过叠氮化、还原、乙酰化,最后得到了利奈唑胺。改进后的工业化工艺成功地克服了该问题,而且收率在相对之前方案中大大提高了[19](合成路线见图)。35096
利奈唑胺的已知合成路线代表主要有以下四种:
1 路线一
此路线是以吗啉和3,4- 二氟硝基苯为原料,通过二异丙基乙胺结合,再利用钯碳催化氢化得到含氟取代苯胺中间体,再将中间体的氨基用氯甲酸苄(CBZ-Cl)保护之后,于强碱、低温条件下与环氧乙基甲基丁酸酯环合形成噁唑烷酮环,再经甲磺酰化反应、叠氮化钠反应、氢化还原反应,最后乙酰化反应得到目标化合物[20]。
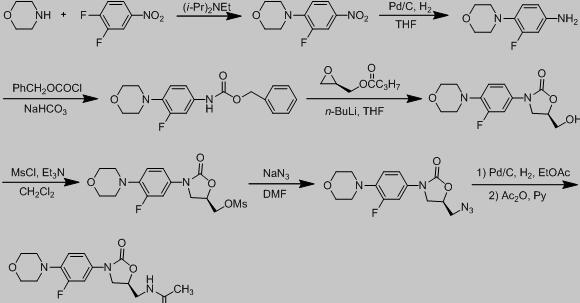
图 路线一合成步骤
纵观此路线不难发现,需采用剧毒的叠氮化钠试剂,环合的时候还得保持温度在-78。C以下,且合成步骤很长,在时间,条件,以及物料使用上都是苛刻的。
2 路线二
含氟取代苯胺中间体与路线一一致,随后经重氮化反应、Sandmeyer 反应得到取代溴苯,取代溴苯再在碘化亚铜的催化下与苄基噁唑烷酮化合物偶联结合,最后经氢化脱苄反应、乙酰化反应得到目标化合物[21]。
图2.2 路线二合成步骤
此路线比路线一好在,其避免了使用易引起爆炸的剧毒叠氮化钠试剂,但同样地,其反应路线依旧很长,花费时间很长,同样不利于研究。
3 路线三
此路线是以对氯苯甲醛和(S)-环氧氯丙烷为起始原料在氨水的作用下,反应得到亚胺结构中间体。亚胺中间体和经CBZ保护的取代苯胺在叔丁醇锂的作用下,反应环合形成噁唑烷酮环化合物,此化合物再经盐酸水解反应、乙酰化反应得到最终化合物[22]。
图2.3 路线三合成步骤
此路线采用汇聚合成的方法,合成路线也缩短了,使得目标产物的产率得以提高,且避免使用剧毒试剂,但是,同样的噁唑烷酮环形成步骤的反应条件较为苛刻。
4 路线四
此路线以3-氟苯基异氰酸酯与(R)-环氧氯丙烷为起始原料,在溴化锂、三正丁基氧磷的作用下就进行环合得到噁唑烷酮环化合物,此化合物再与叠氮化钠反应得到叠氮噁唑烷酮化合物,再经催化氢化反应、乙酰化反应得到目标化合物重要的部分中间体。此中间体经Na3BO3/Na2WO4 氧化后溴代,再在碘化亚铜催化下与吗啉偶联结合,得到最终化合物[23]。
7参考文献
[1] 田玉妙. 头孢拉定的合成研究. 硕博学位论文[J], 2007年
[2] SeivakumarN, gaheem M.A.,Khera M.K.,et a1..Influence of ethyleneoxy spacer group on the activity of linezolid:synthesis of potent antibacterials possessing a thiocarbonyl group,Biooraganic& Medicinal Chemistry Letters[J], 2003, 13(23): 4169-4172
[3] Cui Y.J.,Dand Y. X.,Yang Y.S,et a1.,Syntheses and antibacterial activity of a series of 3-(pyridine-3-y1)-2-oxazolidinone.European Jouranl of Medinal Chemistry[J], 2005, 40(2): 209—214
[4] Phillips O. A., UdoE.E., Ali A.M., ela1., Synthesis and antibacterial activity of 5-substituted oxazolidinones, Biooraganic& MedicinalChemistryLetters[J], 2003, 13(1): 3l-35
[5] TakhiM., Murugan C., Munikumar M., Synthesis and antibacterial activity of novel oxazolidinones bearing N-hydroxyacetamidine substituent,Biooraganic&Medicinal Chemistry letters[J], 2006, l6(9): 2391-239 利奈唑胺的合成文献综述和参考文献:http://www.youerw.com/wenxian/lunwen_32892.html

